研究火熱的“銅死亡”
2022年3月17日,美國哈佛大學和麻省理工學院布羅德研究所的TODD R. GOLUB團隊合作,在頂級學術期刊Science發表題為“Copper induces cell death by targeting lipoylated TCA cycle proteins”的研究性論文,作者發現:細胞體內依賴于銅離子且受到調控的新的細胞死亡方式--“銅死亡”(Cuprotosis)。
在過去約30年中,細胞死亡研究已經走了很長一段路,除了揭示基本生物學過程的機制外,它還帶來了針對癌癥和其他疾病(例如某些自身免疫性病理學或傳染病)的新療法,其中細胞凋亡、細胞焦亡、細胞壞死和鐵死亡,是近年來研究得最為廣泛的幾種形式。(點擊查看相關“細胞生物學”專題文章),這里我們了解下最新報道的“銅死亡”。
1. “銅死亡”
TODD R研究團隊揭示的“銅死亡”是一種全新的、受調控的細胞死亡方式。銅離子直接結合三羧酸(TCA)循環中的硫辛酰化組分,導致硫辛酰化蛋白的異常聚集,Fe-S簇蛋白表達下降,從而引起蛋白毒性應激反應并導致細胞死亡。
這意味著可以針對相關分子,制定出一套更有效的銅離子載體治療方案,特別是針對FDX1、硫辛酰化水平高,依賴線粒體呼吸的腫瘤類型。因此,“銅死亡”作為最新提出的一種細胞死亡機制,引起學術界的振奮!
2.“銅死亡”調節機制
通過TODD R團隊的研究結果部分,我們可以了解到銅離子載體導致細胞死亡的機制,具體結果分析過程如下:
1)銅離子載體誘導的細胞死亡是新型的細胞死亡
首先研究團隊發現,銅離子載體均能殺傷細胞,且使用銅離子載體Elesclomol,可調控銅介導的細胞死亡。那這種死亡方式,是否區別于已知的死亡方式(細胞凋亡、細胞壞死、鐵死亡)?為了進一步驗證,團隊通過敲除凋亡關鍵效應因子Bax和BAK1,結果發現未能阻止銅離子載體誘導的細胞死亡,說明其細胞死亡機制明顯不同于已知的細胞死亡途徑。這些數據證實,銅離子載體誘導的細胞死亡是一種全新的細胞死亡形式。

圖1. 銅離子載體誘導的細胞死亡是新型的細胞死亡 [1]
2)線粒體呼吸調節銅離子載體誘導的細胞死亡
緊接著,TODD R團隊發現線粒體呼吸在這種死亡機制中發揮關鍵作用。實驗數據表明,當細胞依賴于線粒體呼吸時,其對銅離子載體的敏感性比進行糖酵解細胞高近1千倍;使用線粒體抗氧化劑、脂肪酸以及線粒體功能抑制劑處理細胞,會顯著影響細胞對銅離子載體的敏感性。
此外,線粒體解聚物FCCP對銅離子載體誘導的細胞死亡沒有影響;隨后團隊檢測了細胞不同類型的缺氧刺激,與銅離子載體處理對細胞耗氧率(OCR)的影響,數據表明,銅不會直接針對電子傳遞鏈(ETC),而是只在三羧酸(TCA)循環中發揮作用。這些論證表明,銅誘導細胞死亡所必需的是線粒體呼吸。
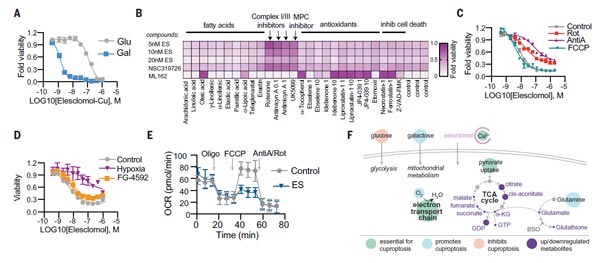
圖2. 線粒體呼吸調節銅離子載體誘導的細胞死亡 [1]
3)FDX1與蛋白硫辛酰化是銅離子載體誘導細胞死亡的關鍵介質
為進一步明確細胞死亡的代謝路徑,研究團隊使用了全基因組CRISPR-Cas9功能缺失篩選,并采用不同結構的銅離子載體進行處理,以提高篩選的普遍性。團隊對3千種代謝酶進行獨立的敲除篩選。
從以上的篩選中,他們找到了七個正調控基因(FDX1、LIAS、LIPT1、DLD、DLAT、PDHA1和PDHB)以及三個負調控基因(MTF1、GLS和CDKN2A),其中鐵氧還蛋白 1基因(ferredoxin 1,FDX1)和蛋白質硫辛酰化(Protein lipoylation)是銅離子載體誘導細胞死亡的關鍵調控因子。通過個別基因敲除研究,缺失FDX1和硫辛酸合酶基因(lipoic acid synthase,LIAS)可增強對銅誘導的細胞死亡的抵抗力,進一步說明FDX1和蛋白硫辛酰化與銅離子載體誘導的細胞死亡之間的功能聯系。這些研究表明,FDX1與蛋白硫辛酰化是銅離子載體誘導細胞死亡的關鍵介質。
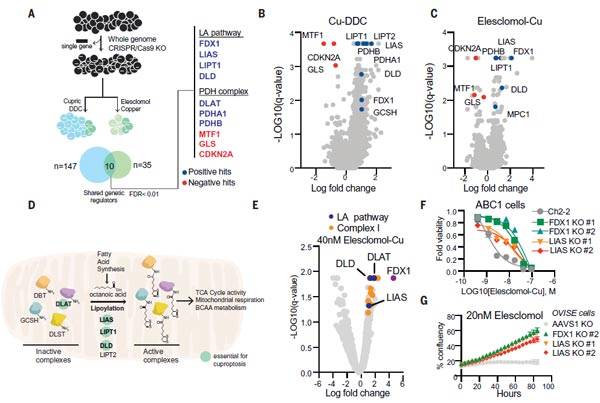
圖3. FDX1與蛋白硫辛酰化是銅離子載體誘導細胞死亡的關鍵介質 [1]
4)FDX1是蛋白硫辛酰化的上游調控因子
進一步的,研究團隊發現,敲除FDX1或硫辛酰化相關酶均可以保護細胞免遭銅毒性,因此,他們提出猜想,FDX1可否為蛋白質硫辛酰化的上游調節因子?通過癌癥依賴性圖譜(Cancer Dependency Map)等公共數據庫,他們發現FDX1和硫辛酰化相關酶與細胞存活高度相關。
隨后,他們對208例人類腫瘤標本進行FDX1和硫辛酸途徑蛋白的免疫組化(IHC)染色分析,結果顯示FDX1和硫辛酰化蛋白的表達高度相關;WB實驗又進一步確認了FDX1的敲除會導致二氫硫辛酰胺轉乙酰基酶基因(Dihydrolipoamide S-Acetyltransferase,DLAT)和二氫硫辛酰胺S-琥珀酰轉移酶(DLST,Dihydrolipoamide S-Succinyltransferase)的蛋白硫辛酰化缺失;通過代謝物分析發現,FDX1的缺失會導致丙酮酸和α-酮戊二酸的積累,琥珀酸的消耗,以及LIAS的關鍵底物S-腺苷甲硫氨酸(SAM)的積累。以上數據證實,FDX1參與調節蛋白的硫辛酰化過程。
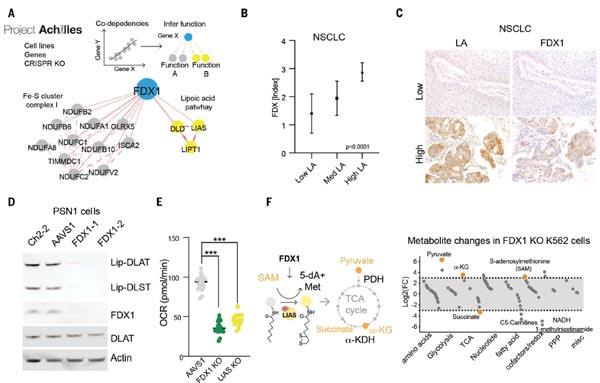
圖4. FDX1是蛋白硫辛酰化的上游調控因子 [1]
5)銅直接結合硫辛酰化DLAT并誘導其寡聚化
通過前面的實驗,作者建立了銅死亡和蛋白質脂酰化之間的聯系,但只是間接證實FDX1和硫辛酰化的蛋白在銅死亡中的重要性,沒有建立直接的機制聯系。那么,銅是否直接與脂酰化蛋白質結合呢?
為此,研究團隊在FDX1敲除細胞與正常細胞的裂解液中純化出DLAT和DLST兩種蛋白,結果發現正常細胞中的DLAT和Lip-DLST(硫辛酰化狀態),會直接與銅離子結合,但不與鈷或鎳樹脂結合。而FDX1敲除細胞中的DLAT和DLST(去硫辛酰化狀態)則不與銅結合,表明蛋白的硫辛酰化修飾,是直接結合銅的必要條件。
此外,對Elesclomol敏感細胞的處理會增加DLAT寡聚體的水平,而對Elesclomol不敏感細胞系或FDX1敲除處理,只有在Elesclomol高濃度下才能導致DLAT寡聚。通過質譜分析進一步發現,銅離子載體處理還可導致Fe-S簇蛋白的水平降低。以上數據表明,銅直接結合硫辛酰化DLAT并誘導其寡聚化。

圖5. 銅直接結合硫辛酰化DLAT并誘導其寡聚化 [1]
6)銅過量導致的細胞死亡機制與銅離子載體誘導的細胞死亡機制是同一種機制
研究到這兒,通過以上1-5的驗證,銅死亡的機制已揭曉:銅離子載體誘導細胞內銅離子水平上升至超過閾值,過量的銅促進硫辛酰化蛋白聚集,并使Fe-S簇蛋白不穩定,導致細胞蛋白毒性應激增高,最后誘導細胞死亡。但是,團隊再次提出疑問:銅離子載體誘導的細胞死亡與自然發生的銅穩態功能障礙是否是同一種分子機制導致?
為探索其潛在聯系,研究者首先在人胚胎腎HEK 293T和ABC1細胞中過表達銅運載體SLC31A1(銅穩態的關鍵靶點),數據表明,銅輸入顯著增強了細胞對線粒體呼吸相關蛋白的總消耗,導致蛋白硫辛酰化減少,Fe-S簇蛋白水平降低,HSP70應激蛋白水平升高。
更值得關注的是,過表達SLC31A1的細胞中,鐵死亡、壞死性凋亡、凋亡抑制劑和抗氧化劑,均都不能阻止銅誘導的細胞死亡,但銅螯合劑、FDX1 Knockdown和LIAS Knockdown卻可以減輕細胞死亡現象。
最后,研究者采用Wilson's disease小鼠模型發現,老年Atp7b缺陷小鼠的肝臟中,蛋白的硫辛酰化水平和Fe-S簇蛋白的含量,均顯著降低,Hsp70蛋白則升高。通過多種模型分析,基因誘導下的銅過量導致的細胞死亡機制與銅離子載體誘導的細胞死亡機制是同一種機制。

圖6. 銅過量導致的細胞死亡機制與銅離子載體誘導的細胞死亡機制是同一種機制 [1]
3.“銅死亡”相關熱門靶點
目前該研究中,作者主要發現了多個與“銅死亡”代謝途徑特異性相關的調節基因。這些關鍵調節因子在“銅死亡”過程中的具體作用,以及銅毒性治療癌癥的有效性將是未來的研究熱點。
華美生物匯總了當前與“銅死亡”相關信號通路中,大部分熱門靶點抗體產品,點擊靶點對應貨號可查看相關試劑(具體詳情見下表)。
“銅死亡”熱門靶點抗體產品匯總:
| 信號通路 | 調控方式 | 關鍵靶點 | 貨號 | 宿主 | 反應種屬 | 適用應用 |
|---|---|---|---|---|---|---|
| 硫辛酰途徑 | 正調控 | DLD | CSB-PA006928LA01HU | Rabbit | Human, Mouse, Rat | ELISA, WB, IHC |
| CSB-PA783949 | Rabbit | Human, Mouse, Rat | ELISA, IHC | |||
| DLAT | CSB-PA006926LA01HU | Rabbit | Human | ELISA, WB, IP | ||
| CSB-PA445587 | Rabbit | Human, Mouse, Rat | ELISA, WB, IHC | |||
| 丙酮酸脫氫酶(PDH)復合物體途徑 | LIAS | CSB-PA012927LA01HU | Rabbit | Human | ELISA, WB, IHC | |
| PDHA1 | CSB-PA017715LA01HU | Rabbit | Human | ELISA, IHC, IF | ||
| CSB-PA247984 | Rabbit | Human | ELISA, WB, IHC | |||
| PDHB | CSB-PA017717ESR2HU | Rabbit | Human | ELISA, IHC | ||
| CSB-PA017717GA01HU | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC | |||
| 負調控 | GLS(GAM/GAC/KGA) | CSB-PA009528DA01HU | Human, Mouse | Rabbit | ELISA, WB, IHC | |
| CSB-PA969762 | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC | |||
| CSB-PA177709 | Human, Mouse, Rat | Rabbit | ELISA, IHC | |||
| MTF1 | CSB-PA013754LA01HU | Human | Rabbit | ELISA, WB, IHC, IF | ||
| P16-INK4A(CDKN2A) | CSB-PA005089LA01HU | Human | Rabbit | ELISA, IHC | ||
| CSB-PA003618 | Human, Mouse | Rabbit | WB, ELISA | |||
| 甘氨酸裂解酶系統(GCS)系統途徑 | / | GCSH | CSB-PA009335GA01HU | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC, IF |
參考文獻:
1. Tsvetkov, Peter, et al. "Copper induces cell death by targeting lipoylated TCA cycle proteins." Science 375.6586 (2022): 1254-1261.






