超越干細胞,癌癥研究新風向,為何它能開啟精準醫學新時代?
日期:2020-12-18 14:06:05

在和癌癥斗爭的歷史里,人類做過無數次的嘗試,從小分子研究,到大分子核酸、多樣性蛋白,再到細胞治療,從未停歇腳步。而干細胞的出現極大地推動了再生醫學的發展,涵蓋了基于細胞的高通量藥物篩選、細胞移植和器官移植等應用領域,展現了廣闊的應用前景。
而醫學界近幾年最熱門的研究——外泌體,作為介于分子和細胞之間的微小結構,原以為是干細胞所代謝出的廢棄物,經多年研究卻發現它在治療疾病、修復身體機能上占有不可缺席的地位!源自于干細胞的外泌體也成為了關注的熱點,為疾病的診斷和治療帶來了新思路。
外泌體用途比干細胞更廣,關鍵在于:不會被身體排斥。
Oncogene十月刊發了膀胱癌中MSC衍生的外泌體miR-139-5p功能的研究。
microRNA可以通過間充質干細胞(MSC)衍生的外泌體傳遞至腫瘤細胞,發揮其功能。RNA定量檢測發現復合物PRC1(polycomb repressor complex 1)在膀胱癌中表達上調,體外實驗證實PRC1沉默阻礙腫瘤細胞的增殖、遷移和侵襲能力。雙熒光素酶報告基因實驗證實PRC1受miR-139-5p的調控。接下來,將膀胱癌細胞與從過表達miR-139-5p的人臍帶間充質干細胞(hUCMSCs)中分離出來的外泌體共培養,來自hUCMSCs的外泌體的miR-139-5p可以轉移到膀胱癌細胞中,下調PRC1的表達。此外,體內體外實驗均證實hUCMSCs衍生的外泌體miR-139-5p具有抑制膀胱癌發展的作用。這一結果突顯了利用MSC衍生的外泌體miR-139-5p治療膀胱癌是一種有前景的治療策略。
2013年,外泌體因諾貝爾醫學獎而被眾人知曉,也因此將外泌體研究推向了前所未有的新高潮。外泌體在體液中廣泛存在及易獲得性等特點被譽為液體活檢"新秀",成為疾病的精確診斷和治療研究的熱點。

外泌體是什么
外泌體(Exosomes)是一種能被機體內大多數細胞分泌的直徑大約為30-150 nm 的具有脂質雙層膜的微小膜泡,它廣泛存在并分布于血清、血漿、唾液、尿液、腦脊液和乳液等多種體液中。
外泌體攜帶和傳遞重要的信號分子,包含細胞溶質蛋白、 參與細胞內信號轉導的蛋白、各種代謝酶、熱休克蛋白和四跨膜蛋白及特殊蛋白質,參與細胞活動的重要調控,形成了一種全新的細胞間信息傳遞系統,影響細胞的生理狀態并與多種疾病的發生與進程密切相關。
外泌體的表面marker主要有CD9、CD63、CD81、PKM、ENO1、TSG101、熱休克蛋白家族等。其中脂質雙分子層中含有豐富的Phosphatidylserine。
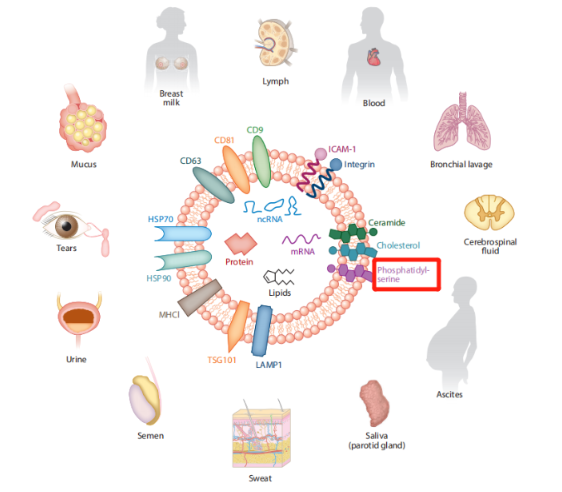
▲圖片來源:Exosomes:Fundamental Biology and Roles in Cardiovascular Physiology
外泌體投資熱潮涌現
作為液體活檢領域的"三大標桿"之一,外泌體被認為是細胞間通訊、疾病診斷和預后循環生物標志物的重要載體,外泌體通過其攜帶的脂質、核酸、蛋白質、miRNA等來調節受體細胞的生物學活性,從而參與機體免疫應答、細胞遷移、腫瘤侵襲、抗原提呈等生物學過程。大量的證據表明外泌體及其內容物具有成為新型診斷標志物的潛能,在臨床和治療方面展現出了極具前景的研究價值。
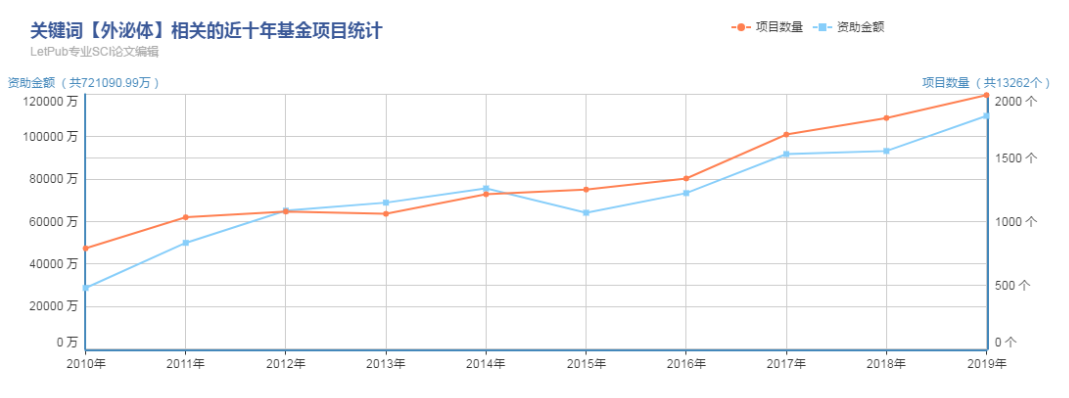
在學術研究方面,國家自然基金項目查詢所示:近10年,外泌體相關項目數量從500上升到了接近2000個(數量上增加了近4倍);資助金額增長了近6倍。2019年的外泌體相關的國家自然科學基金中標總計已達2.13億元,較2018年1.69億元增長26%,2018較2017年1.23億元增長37%。
外泌體受到越來越多的關注,涌現了大批的外泌體相關研究課題,以迅雷不及掩耳之勢火了起來。
而在資本的助力下,外泌體在治療和診斷方向的應用也從實驗室的研究階段迅速推進,迎來了產業化合作新浪潮,成為下一個群雄角逐的黃金賽場。外泌體產業在歐美日已蓬勃發展,迄今為止,全球約有40多家外泌體治療和診斷的公司。
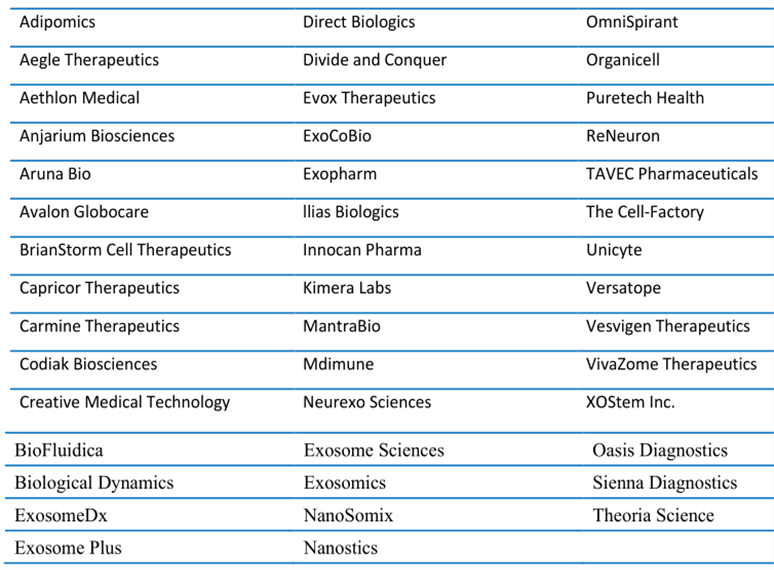
▲外泌體公司列表
Codiak BioSciences作為投資者的寵兒,2019年1月,生物制藥公司Jazz Pharmaceuticals和Codiak BioSciences宣布價值10億美元的戰略合作,共同研究、開發和商業化工程外泌體,為難以治療的癌癥創建外泌體療法。
2020年6月份,禮來、武田、拜耳宣布了與外泌體公司高達20億美元的交易。其中,禮來與英國Evox Therapeutics 簽署了一項價值 12 億美元的合作協議,未來雙方將利用Evox專有的外泌體藥物遞送平臺,開發RNA干擾和反義寡核苷酸藥物有效遞送載體,用于神經系統疾病的治療。
外泌體最新研究進展
外泌體從發現至今已有30多年的歷史,雖然最初被認為可能是細胞的“垃圾”,所以才被排出來,但是近年來研究表明外泌體具有功能活性并可進行細胞間信息傳遞。作為信號分子的載體,外泌體在生物體內介導多個核心生物過程,包括免疫監視、炎癥抑制反應、干細胞未分化狀態的維持與可塑性、鄰近和遠端細胞的增殖與凋亡抑制等。
白癜風是由自體表皮黑色素細胞的逐步破壞引起的皮膚脫色疾病。適應性免疫中CD8+、Treg和Th17細胞失衡為特征的自身免疫性不耐受被認為是造成白癜風中黑色素細胞破壞的主要原因。Autoimmun Rev 9月刊的一篇文章調查了外泌體與白癜風的關聯,強調了外泌體的免疫調節作用。在病理和生理條件下,外泌體途徑對于調節CD8+,Treg和Th17細胞都是必需的。在病理條件下,分泌的外泌體可影響疾病微環境中CD8+,Treg和Th17細胞的平衡,環境失衡可能破壞自身免疫耐受,導致白癜風。另外,外泌體在黑色素生成途徑中,充當角質形成細胞和黑色素細胞之間通信的介質,可能也參與黑素小體的運輸。
越來越多的研究表明脂肪組織、炎癥反應、非酒精性脂肪性肝(NAFLD)和酒精性脂肪性肝(AFLD)與肝細胞肝癌(HCC)的發生密切相關。最近,美國北卡羅萊那中央大學的研究者們提出脂肪細胞分泌的外泌體(AdExos)和HCC分泌的外泌體(HCCExos)營造了一個持續的慢性炎癥環境,導致HCC進展。AdExos和HCCExos均含有細胞特異性的細胞內分子,包括各種mRNAs、microRNAs、lncRNAs、circRNAs、脂質、代謝物以及蛋白。作為自分泌或旁分泌的信號分子,這些內含物能激活與細胞增殖、血管生成、細胞浸潤、腫瘤惡化相關的信號通路,形成腫瘤微環境中脂肪細胞和HCC的動態互聯,造成HCC進展。
免疫檢查點抑制劑(ICI)的誕生是抗腫瘤藥物領域的重大創新,然而最近有報道表明ICI的抗腫瘤治療會引起不良心血管事件。不良心血管事件包括心肌炎與心肌病、心肌纖維化、心力衰竭和心包病變等。心臟的衰老過程伴隨著各種心臟疾病的發生。外泌體通過傳送各種生物分子(包括microRNA)來調控心臟疾病中細胞間的通訊聯系。miR-34a-5p是一個與心臟衰老相關的microRNA。溫州醫科大學的研究者們利用小鼠疾病模型研究了外泌體miR-34a-5p與PD-1抑制劑引起的心血管不適之間的關聯。他們發現,PD-1抑制劑處理過的巨噬細胞衍生的外泌體通過調控miR-34a-5p/PNUTS信號通路發揮促心肌衰老的作用。這一結果在線發表在J Immunother Cancer十月刊。
外泌體市場/臨床應用
腫瘤患者血清中分離的外泌體,其內含物miRNAs的表達譜與腫瘤進展緊密關聯。外泌體miRNAs被發現在反復凍融的環境里、在-208 °C的超低溫下存儲5年仍然保持穩定。外泌體miRNAs的高穩定性使其成為監測疾病進展的有價值的生物標志物。目前已在多個腫瘤類型中,包括非小細胞肺癌、鼻咽癌、胃癌、前列腺癌、卵巢癌、乳腺癌等,鑒定出可用于監測腫瘤進展的外泌體來源的分子標記。
2016年,依賴外泌體譜的腫瘤診斷產品在美國上市。ExoDx Prostate(IntelliScore)和ExoDx Lung(ALK)是基于液體活檢方法的兩種商品化檢測試劑盒,可分別用于檢測血清和尿液中前列腺癌或肺癌標志物。對于肺癌和前列腺癌,常規的診斷方法是侵入性診斷法。而ExoDx Prostate(IntelliScore)使用非直腸指診尿樣,分析樣本中高分型前列腺癌患者攜帶的三種標志物,然后使用專有算法分析結果并預測患病風險。同樣,ExoDx Lung(ALK)利用定量PCR方法分析血清中的外泌體RNA,可檢測非小細胞肺癌中五種不同的EML4-ALK融合基因轉錄本,此方法可用于有患肺癌風險人群的預后檢測。
由于外泌體具有與當前用作藥物遞送系統的納米顆粒相似的特性,比如穩定性、通透性、免疫原性較低、毒性較低、生物相容性高等,外泌體也可被用作臨床治療的給藥工具。臨床藥物研究中,除傳統的化療藥物外,天然產物和干擾小RNA已成功封裝在外泌體中,用于靶向治療乳腺癌、胰腺癌、肺癌、前列腺癌和成膠質細胞瘤。
外泌體分離提取
外泌體的分離方法有很多種,常用的有超速離心法、密度梯度超速離心法、多聚物沉淀法(PEG)、免疫磁珠法、試劑盒分離法等。
商品化試劑盒多采用聚乙二醇沉淀法、超濾法和免疫學方法分離外泌體。
超速離心法和密度梯度離心法是最常用的外泌體純化手段。這兩種手段因獲得的囊泡數量較多而廣受歡迎,但過程比較費時,而且對儀器設備要求高(需要超速離心機)且回收率不穩定,純度也達不到要求。
多聚物沉淀法操作簡便,不需要額外的設備,然而PEG沉淀會夾雜分離大量雜質(蛋白、脂類等),顆粒大小不均一,存在于分離物中的聚合物也可能會干擾下游分析。
免疫磁珠法利用包被單克隆抗體的磁珠結合外泌體,可保證外泌體形態的完整,特異性高,但免疫沉淀需要特異性抗體,檢測成本高,且僅能捕獲表達特定抗原的目標外泌體,效率低,外泌體生物活性易受pH和鹽濃度影響,囊泡完整性是個調整,不利于下游實驗。
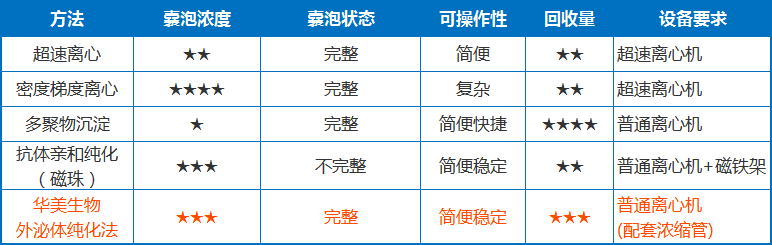
綜上所述,現有技術的方法提取到的外泌體,缺陷在于:收率較低,耗時長、純度不高,外泌體囊泡不完整等。
鑒于上述問題,武漢華美生物工程有限公司研發的外泌體提取試劑盒提供了一種簡單可靠的方法可從細胞培養上清液,血清,血漿,乳液,尿液,唾液,酵母中提取完整的外泌體。該產品提取的外泌體囊泡適用于下游的電鏡分析、NTA分析、納米流式(NanoFCM)分析、Western Blot、熒光定量(qPCR)和高通量測序等應用。
該試劑盒通過蛋白親和的方式分離外泌體,無需超速離心即可實現高效率地從各種類型樣本中提取高純度、囊泡結構完整的外泌體,具有簡便、穩定、易操作的優點。
武漢華美生物工程有限公司(www.artbeat.cn)成立于2007年12月,是一家集科研、生產、銷售為一體的生物高新技術企業。并形成了以CUSABIO為品牌的ELISA試劑盒、蛋白、抗體等多種優質產品,遠銷歐美日德等九十多個國家。
2018年3月31日,華美生物兄弟公司生之源與2013年諾貝爾生理學或醫學獎得主蘭迪·謝克曼教授舉行簽約儀式,并建立諾貝爾獎工作站。此舉大大助推了華美外泌體相關科研產品的研究和生產!
華美生物研發的外泌體(Exosome)提取試劑盒廣泛兼容各種樣本類型和各種細胞上清液(如A375,HEPG2,PC-3,Hela,U87,MG63等),為廣大生物醫學科研學者提供高質量的產品與技術服務。
外泌體研究吸引著生命科學各個領域的科學家。華美CUSABIO提供外泌體提取試劑盒,將助力研究人員探秘其功能,擴大其醫學應用。
現限時像廣大科研用戶提供免費試用裝!更期待您的使用反饋~

外泌體未來展望
外泌體爆炸性研究活動已經慢慢演變為分子醫學的快速發展。外泌體在臨床醫學中有十分光明的應用前景,主要是因為它們含有豐富的生物標志物,可用于監測臨床狀態、診斷疾病、治療反應、疾病進展等。重要且有影響力外泌體研究領域會隨著高效率的外泌體分離技術的發展而發展。
外泌體可作為生物標志物用于疾病的診斷,也推動了以外泌體為靶標的治療方法研究或將外泌體本身用作治療工具的研究。將外泌體用作治療工具的臨床研究正在開展之中,其目的是研究患者自身MSC分泌外泌體或健康捐贈者體內外泌體用于治療的安全性和有效性。這個趨勢下,外泌體用作藥物輸送系統作為基因治療的潛在載體有可能變得更加普遍。外泌體在癌癥中同時發揮免疫激活和免疫抑制功能,外泌體腫瘤免疫療法有望誕生抗癌疫苗。更全面的了解外泌體功能,促進“有益”外泌體的分泌,抑制“有害”外泌體的分泌,從而實現疾病的預防與治療。隨著完整外泌體和它們的功能的逐漸解密,預計在不久的將來,更多令人興奮的外泌體應用將會出現。
—END—
——華美生物·讓科研變得有溫度!——










